【病因学】 根据病因可分原发和继发性两大类:原发性者占绝大多数,病因和发病机理不明。继发性者占少数.
【病因学】
根据病因可分原发和继发性两大类:原发性者占绝大多数,病因和发病机理不明。继发性者占少数,如肢端肥大症中垂体性糖尿病、柯兴综合征中类固醇性糖尿病等。
(一)糖尿病 各型特点如下:
1.胰岛素依赖型(IDDM,Ⅰ型) 其特征为:①起病较急;②典型病例见于小儿及青少年,但任何年龄均可发病;③血浆胰岛素及C肽水平低,服糖刺激后分泌仍呈低平曲线;④必须依赖胰岛素治疗为主,一旦骤停即发生酮症酸中毒,威胁生命;⑤遗传为重要诱因,表现于第6对染色体上HLA某些抗原的阳性率增减;⑥胰岛细胞抗体(ICA)常阳性,尤其在初发病2~3年内。有时在发病前数年常已呈阳性反应。近年来研究表明在Ⅰ型患者的鉴定中,谷氨酸脱羧酶抗体(抗GAD)阳性反应较ICA更有意义,尤其在病程较久,发展较慢的患者。
2.非胰岛素依赖型(NIDDM,Ⅱ型) 其特征为:①起病较慢;②典型病例见于成人中老年,偶见于幼儿;③血浆胰岛素水平仅相对性降低,且在糖刺激后呈延迟释放,有时肥胖病人空腹血浆胰岛素基值可偏高,糖刺激后胰岛素亦高于正常人,但比相同体重的非糖尿病肥胖者为低;④遗传因素亦为重要诱因,但HLA属阴性;⑤ICA呈阴性;⑥胰岛素效应往往甚差;⑦单用口服抗糖尿病药物,一般可以控制血糖。根据体重又可分为不胖和肥胖两型。在不胖的NIDDM中,实际上尚包括一些自身免疫病变进行甚慢的Ⅰ型患者,其初期临床表现酷似NIDDM而按MIDDM处理,久后终于逐步充分表现出Ⅰ型的特点,必须应用胰岛素才能免于发生酮症酸中毒,故在确诊时,年龄往往较大,抗GAD阳性结果明显高于NIDDM,76%:12%。可称之谓成从迟发自身免疫型糖尿病(LADA),有人也称1.5型糖尿病。晚近国内外报道的线粒体基因突变糖尿病,由于其临床特点呈不典型NIDDM:起病早,无肥胖,病程中常需改用胰岛素治疗和胰岛β细胞功能日益减退,同时尚伴有神经性耳聋,故很可能即属于LADA之一种。目前对线粒体糖尿病的认识正在深入中。
NIDDM中,尚有一类发病在25岁之前,在5年内不用胰岛素便能控制高血糖,一般不发生酮症酸中毒,称为青年人中老年型糖尿病(MODY),多属常染色体显性遗传,其微血管并发症与一般NIDDM同样常见,但大血管并发症较少。
3.与营养不良有关的糖尿病 其特征为:①此型大多见于亚、非、南美等第三世界发展中国家,在热带或亚热带地区,故又称热带性胰源糖尿病等,命名多种,后经WHO定名为与营养不良有关的糖尿病;②起病年龄大多为青少年(15~30岁);③形体消瘦,营养不良;④不少病例须用胰岛素治疗,有时剂量偏大;⑤但酮症不多见;⑥此型又可分下列二亚型:
⑴胰纤维结石型:①病理上以慢性胰纤维化,胰体缩小,胰管扩大,内有钙化结石,以致外分泌与内分泌均受累;②起病于青少年,男女之比为3∶1;③以慢性反复发作性腹痛、腹泻、消化不良、营养缺乏等慢性胰病为特征;④血糖有时可很高,达400~600mg/dl(22~33mmol/L);⑤约80%须胰岛素治疗;⑥但即使停药,酮症罕见;⑦病人大多于40~50岁死亡,亦可呈各种慢性糖尿病并发症;⑧目前病因不明,有疑为多食木薯而得慢性CN中毒引起。此病又称Z型,因1955年首见于Zuidema。相似病例,我院曾见1例,有病理解剖证实。
⑵蛋白质缺乏型:此型又称J型或M型,因1955年首见于Jamaica。特征为:①起病于15~25岁的青少年;②有长期蛋白质与能量营养不良史,以致极度消瘦,BMI常<19;③血糖中度升高,须胰岛素治疗;④酮症罕见;⑤亚洲此病男女之比为2~3∶1,非洲男女相等,西印度则以女性较多;⑥病因不明,可能由于长期营养不良,β细胞数及功能低下所致,但与IDDM不同,糖刺激后仍有C肽释放。
4.继发性及其他
⑴胰源性:由于胰腺切除、胰腺炎、胰癌、血色病等引起的胰岛素分泌不足。
⑵内分泌性:①垂体性糖尿病,由于生长激素分泌过多,见于肢端肥大症或巨人症;②类固醇性糖尿病,由于皮质醇类激素分泌过多,见于库欣病或综合征;③胰升血糖不经瘤所致的糖尿病,由于胰岛A(α)细胞瘤分泌胰升血糖素过多;④胰生长抑素瘤所致的糖尿病,由于胰岛D(δ)细胞腺瘤分泌生长抑素过多等。
⑶药源性及化学物性:多种药物、化学物可影响糖代谢。如利尿降压药噻嗪米、糖皮质激素、女性口服避孕药、止痛退热(阿司匹林、消炎痛等)、三环抗抑制剂中阿密替林、去甲丙咪嗪等大都仅能引起糖耐量减退。
⑷胰岛素受体异常:又分:①受体本身缺陷有先天性脂肪营养异常症(congenital lipodystrophy)及黑棘皮病伴女性男性化;②受体抗体所致的胰岛素耐药性糖尿病。
⑸遗传性综合征伴糖尿病:有多种:①代谢紊乱如Ⅰ型肝糖原沉着症、急性阵发性血卟啉病、高脂血症等;②遗传性神经肌肉病如糖尿病性视神经萎缩伴尿崩症与耳聋等;③早老综合征;④继发于肥胖的葡萄糖不耐受性综合征如Prader-Willi综合征。
(二)葡萄糖耐量减退(impaired glucose tolerance,简称IGT) 此组按诊断标准血糖空腹期<140mg/dl(7.8mmol/L)餐后2小时<200mg/dl(11.1mmol/L)但高于正常者,口服糖耐量试验(OGTT)曲线亦介乎糖尿病与正常高限之间。此组特征为:血糖偏高,但未达糖尿病标准,系糖尿病的候选者,可分为肥胖型和不胖型。这类对象如不及时干预约2/3可转变为糖尿病,饮食和运动干预可减少发病,故为预防发生糖尿病的重要对象之一。
(三)妊娠期糖尿病(gestational diabetes mellitus,简称GDM) 此组限于妇女妊娠期发生的IGT与DM,故已知糖尿病者妊娠时不属此组。大多数病人于分娩后随访OGTT可恢复正常,仅30%以下病人于5~10年随访中转变为真正糖尿病(按WHO标准)。此组病人约见于所有孕妇的1%~2%。
【发病机理】
胰岛素绝对不足大多见于Ⅰ型(IDDM),相对不足大多见于Ⅱ型(NIDDM)病者。绝对不足的证据有以下几点:①空腹血浆胰岛素浓度很低,一般<4µU/ml(正常值为5~20µU/ml),甚至测不出;血及24小时尿中C肽均很低,常不能测出;②用葡萄糖或胰升糖素刺激后血浆胰岛素及C肽仍低,呈扁平曲线;③对磺酰脲类治疗无效;④病理切片上示胰岛炎,早期有淋巴细胞等浸润;后期β细胞呈透明变性、纤维化,β细胞数仅及原来10%。相对性胰岛素分泌不足表现于空腹血浆胰岛素及葡萄糖刺激后胰岛素释放试验中的浓度均低于相应体重的非糖尿病者。但肥胖的Ⅱ型糖尿病者血浆胰岛素浓度基值或刺激后高峰均比正常对照为高,仅比相应体重而非糖尿病者低且高峰延迟出现。葡萄糖刺激后正常人胰岛素高峰见于口服糖后30~60分钟内,Ⅱ型病人的高峰约延迟30~45分钟出现。见图1。
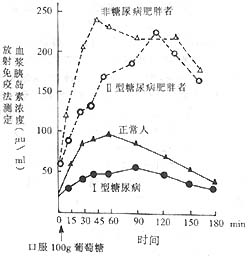
图1 胰岛素释放试验中正常人、非糖尿病肥胖者及Ⅱ型糖尿病肥胖者与Ⅰ型糖尿病人血浆胰岛素浓度对比
注:①正常人空腹血浆胰岛素浓度为5~20µu/ml,口服100g糖后明显增高,约45分钟时达最高峰,胰岛素浓度为250µu/ml以上,3小时后未恢复正常。
②肥胖者(非糖尿病人)空腹血浆胰岛素浓度比正常人为高,口服100g糖后90~120分钟才出现高峰,但低于正常。
③Ⅰ型糖尿病者空腹血浆胰岛素浓度稍低于正常,口服100g糖后90~120分钟才出现高峰,但低于正常。
④Ⅱ型糖尿病肥胖者空腹血浆胰岛素高于正常或正常,口服100g糖后2小时才达高峰,较正常者明显增高,但较相应体重肥胖而非糖尿病者为低。
⑤上述数据说明糖尿病者分泌胰岛素较正常相应体重者为低,且高峰延迟出现,提示胰岛素分泌相对不足,Ⅰ型糖尿病(幼年型、消瘦者)分泌更少
Ⅰ型病者每日胰岛素分泌量最少,空腹基值及糖刺激后峰值均明显低于正常,提示绝对分泌不足。体重正常的Ⅱ型病人胰岛素分泌量低于正常人,且糖刺激后峰值也低而延迟出现,但肥胖糖尿病人的分泌量大于正常人,且空腹基值和糖刺激后高峰明显高于正常人,但延迟出现,提示相对性胰岛素分泌不足且释放反应迟钝。至于胰岛素分泌不足的原因则有下列因素:
(一)遗传因素 不少病人有阳性家族史,我院922例中占8.7%,国外报道约25%~50%。遗传因素不论Ⅰ型或Ⅱ型均较肯定。据近代孪生儿研究,Ⅰ型中共显性为50%,其余为环境因素;Ⅱ型中共显性更高达90%以上。从人类染色体研究中已知Ⅰ型病者第六对染色体短臂上白细胞配伍定型(HLA)等位点上出现频率增减,提示遗传属易感性倾向而非疾病本身。且随人种与民族而异。大量HLA研究总结认为HLA D及DR抗原与Ⅰ型的关联最为重要,尤其是DW3-DR3和DW4-DR4易患Ⅰ型糖尿病。最后又发现DQβ链变异体,与Ⅰ型糖尿病的关系较DR4更密切。DQβ57非天门冬氨酸和DQα52精氨酸可明显增加Ⅰ型糖尿病的易感性,但其影响远不如白种人显著。Ⅱ型患者则HLA无特殊标志。
(二)自身免疫 与Ⅰ型患者关系密切。胰小岛的自身免疫反应主要可能通过分子模拟(Mimicry)过程所致。如某抗原的化学和构成型与β细胞酷似,则该抗原产生的抗体也将针对β细胞发动免疫攻击。抗原可以是病毒,也可以是病毒以外的。至于病毒感染后,β细胞严重破坏而发生糖尿病的学说,由于在流行方式和病毒血清学研究中尚存在不一致的结果以及从发现胰岛细胞损害至出现症状之间当有一个漫长的潜伏期等事实,均表明尚需重新估价。
具有Ⅰ型糖尿病易感基因个体,如接触与β细胞组成酷似的外来抗原(挛生抗原),吞噬细胞即联合Ⅱ类MHC紧密地与之结合,在白介素Ⅰ和Ⅱ的配合下,经辅助T细胞识别后,即对该抗原发动强烈而持久的免疫反应,产生针对该原的特异抗体和免疫活性细胞。由于β细胞酷似外来抗原,因而也受到抗体的攻击。针对外来抗原的抗体与β细胞结合后,吸引吞噬细胞,补体和自然杀伤细胞,吞噬细胞将自身抗原有关信息传递给辅助T细胞,后者进一步扩大针对自身抗原的免疫反应。
Ⅰ型糖尿病患者细胞和体液免疫的证据有:①病者可伴有多种其他免疫性病,如Graves病、桥本氏甲状腺炎、恶性贫血、原发性慢性肾上腺皮质机能减退症等;②可伴有脏器特异性抗体,包括甲状腺、胃壁细胞及抗肾上腺抗体等;③起病较急而于6个月内死亡者有胰小岛炎;其中有T淋巴细胞、NK细胞和K细胞浸润;④白细胞移动抑制试验阳性;⑤胰岛细胞抗体(ICA)免疫荧光测定阳性,在Ⅰ型病例发病1~2年内可高达85%(正常人阳性率仅0.5%~1.7%),后渐下降;后又发现胰岛细胞表面抗体(ICsA)、补体结合胰岛细胞抗体(CF ICA)、细胞毒性胰岛细胞抗体(Cytotoxic-ICA)、64K和38K免疫沉淀抗体等。其中ICsA、CF ICA和免疫沉淀抗体选择性作用于β细胞。⑥近年发现Ⅰ型患者中针对胰小岛细胞抗原的抗体,经鉴定系谷氨酸脱羧酸(GAD),在近期发病的Ⅰ型患者中阳性率为69%,在发病3~42年的患者中仍有59%阳性率,远较病程>3年以上的Ⅰ型患者,ICA的阳性率为高;⑦抑制性T淋巴细胞数及功能降低,K细胞数及活性增高。Ⅰ型患者发病机理见图2。

图2 胰岛素依赖型糖尿病发病机理
(三)胰岛素拮抗激素 据Unger等强调指出,糖尿病中高血糖发病机理不仅由于胰岛素相对和绝对不足,而同时必须有胰升血糖素的相对或绝对的过多。正常人血糖过高时胰升血糖素受抑制,但糖尿病者则不受抑制,尤其在酮症酸中毒时,经胰岛素治疗后方可恢复。未妥善控制的糖尿病中也往往升高。因此,熤中升胰高血糖素血症系一事实,为引起血糖过高的一个组成部分,这是Unger等所提出的二元论学说,即在糖尿病的发病机理中不仅胰岛素相对和绝对不足,而尚同时伴有胰升血糖素的相对或绝对的过高,但确切原因未明。
胰岛D(δ)细胞分泌的生长抑素(GHRIH,SS)对胰岛B(β)细胞分泌胰岛素与A(α)细胞分泌胰高血糖素均有抑制作用,且以抑制胰高血糖素占优势,故可防治IDDM中撤除胰岛素后引起的糖尿病酮症酸中毒。据Unger及Orci推测认为在正常人中此三种细胞分泌三种激素呈旁分泌作用而相互调节,使血糖维持于正常范围内。当B或D细胞功能低下而分泌不足时均可促使胰升血糖素过多而导致高血糖与糖尿病(三元论学说);但Felig等认为在糖尿病发病机理中仍以胰岛素相对或绝对不足为主要病理生理基础,胰升血糖素的作用仅可加强高血糖或为从属的次要因素。
(四)Ⅱ型糖尿病机理 Ⅱ型患者的发病机理与Ⅰ型不同,并非因自身免疫β细胞破坏所致,主要在基因缺陷基础上存在胰岛素抵抗和胰岛素分泌障碍二个环节。多数学者认为胰岛素抵抗系原发异常,但很可能是二者均需存在,只是表现先后,轻重不一而已。可以分为三期:第一期,有胰岛素抵抗和高胰岛素血症,血浆葡萄糖得以维持正常;第二期,胰岛素抵抗加重,虽有高胰岛素血症,但胰岛素愈高,受体愈不敏感,形成恶性特 ,虽有高胰岛素血症,仍出现餐后高血糖症;第三期,胰岛素抵抗仍存在,但胰岛素分泌降低,导致空腹高血糖症。胰小岛分泌功能可因持久的高血糖毒性作用而进一步恶化。在Ⅱ型患者的胰腺中发现有淀粉样物质沉积,此系37氨基酸多肽称胰淀素(amylin)。正常时胰淀素与胰岛素共同贮存在分泌颗粒中,在胰岛素促分泌剂的刺激下与胰岛素同时分泌。在动物实验中,胰淀素可导致胰岛素抵抗。在小岛中胰淀素的积累可能与Ⅱ型患者在晚期时胰岛素分泌衰竭有关。
Ⅱ型或NIDDM患者可以通过以下三水平表现其胰岛素抵抗性。
1.胰岛素受体前水平 1979年Tager等发现突变胰岛素(mutant insulin)引起的糖尿病,于B莲上第25个氨基酸(苯丙氨酸)为亮氨酸所替代而失效,后又发现B链上第24个氨基酸(苯丙氨酸)亦为丝氨酸所替代、A链上第3个氨基酸(缬氨酸)为亮氨酸所替代而失效,均引起糖尿病,提示生物合成中胰岛素基因突变而形成结构异常和生物活性降低的胰岛素导致糖尿病。相似情况由于连接肽上第65个氨基酸(精氨酸)为组氨酸所置换,也有由于连接肽酶可能有缺陷不能使胰岛素原(proinsulin)分解去C肽而形成胰岛素,以致血循环中胰岛素原过多而胰岛素不足,导致糖尿病。但此种异常胰岛素引起的糖尿病在病因中仅占极少数。
2.胰岛素受体水平 胰岛素受体是一跨膜的大分子糖蛋白,由两个α亚基和两个β亚基组成。定位于19号染色体短壁上的胰岛素受体基因编码,含有22个外显子和21个内显子。
胰岛素与细胞α亚基特异性结合后发生构型改变,导致插于细胞内β亚基的酷氨酸激酶活化,这是胰岛素发挥其作用的细胞内修饰的第一步。胰岛素受体基因突变可通过多种方式影响受体的功能:受体生物合成率降低;受体插入细胞膜过程异常;受体与胰岛素的亲和力下降;酪氨酸激酶活性降低;受体降解加速。现已有30种以上胰岛素受体基因点状突变或片段缺失与严重的胰岛素抵抗有关。临床上也已发现多个综合征与胰岛素受体基因突变有关,如妖精症,脂肪萎缩性糖尿病等。
3.受体后水平 胰岛素与其受体的α亚基结合,β亚基酪氨酸激酶活化后,细胞内发生一系列目前尚未清楚的变化,胞浆内或细胞器内底物发生磷酸化和去磷酸化,取决于靶组织的特性和不同的关键酶。胰岛素促进各组织的葡萄糖转运及酵解,肝和肌肉的糖原合成,糖异生和糖原分解的抑制。过程中胰岛素需依赖葡萄糖运出体GLUT4及许多关键酶如葡萄糖(G)激酶,糖原合成酶,磷酸果糖激酶,丙酮酸激酶和丙酮酸脱氢酶等的活性。在其中,GLUT4和G激酶在胰岛素抵抗中的作用,近年来得到深入的研究。GLUT4转动G依赖于胰岛素,后者激活GLUT4并促进其由细胞内微粒体向细胞膜转位,从而促进G转入胞内。已发现肥胖症和Ⅱ型糖尿病患者的脂肪细胞内GLUT4基因表达降低,含量减少,导致胰岛素作用减弱和胰岛素抵抗。G激酶是葡萄糖代谢过程中的第一个关键酶,催化G转变为6-磷酸-葡萄糖,特异地在肝脏和β细胞中表达。许多家系调查调查研究显示青年人中的成年型熤的家系中,G激酶基因呈连锁不平衡,并发现某些基因突变,导致胰岛素抵抗。Ⅱ型和NIDDM发病机理见图3,主要是在遗传基础上综合多种因素的后果,其中以胰岛素或受体后缺陷和胰岛素抵抗以及胰岛β细胞分泌功能障碍为主要环节。

图3 Ⅱ型糖尿病和NIDDN发病机理
(责任编辑:专业医生)
想了解更多信息或 网上预约 健康咨询热线:
我院地址:新化市同丰西路258号(一醉宾馆对面) 点击查看公交线路